A rákot is könnyebb virtuálisan utolérni
Simon István, az MTA Természettudományi Kutatóközpont Enzimológiai Intézetének tudományos tanácsadója, a fehérjeszerkezet-kutató csoport vezetője csaknem negyven éve felhagyott a hagyományos laboratóriumi kísérletekkel. Az USA-ban, a Cornell egyetemen eltöltött hónapok alatt ugyanis megismerkedett a számítógépes vizsgálati módszerekkel, amelyek új utat nyitottak meg számára a fehérjeszerkezet kutatásában.
Simon professzor az elmúlt két évtizedben két nagy fehérjecsaládot vizsgált, egyik a membránba ágyazott fehérjék családja. A fehérjék egyharmada ide tartozik, ezek biztosítják az anyag- és információáramlást a sejt és környezete között, és az ismert gyógyszerek túlnyomó többsége ezeknek a fehérjéknek a működését befolyásolja – hogy mást ne mondjunk – az antidepresszánsok is a membránfehérjékre hatnak.
A gyógyító hatás szempontjából nagyon fontos, hogy tudjuk, a fehérjék mely részei vannak a membránban, melyek a sejten belül és melyek a sejten kívül. Ezt kísérletes szerkezetvizsgálattal nehéz megállapítani, mert ha a fehérjét kivesszük a membránból, hogy hagyományos eszközökkel megvizsgáljuk, kicsapódik, mint a túró, elveszti eredeti szerkezetét. Vannak ugyan bonyolult biokémiai vizsgálatok, amelyekkel eredeti helyén is megvizsgálhatók ezek a fehérjék, de ez idő- és költségigényes, és befolyásolja a fehérje eredeti szerkezetét.
Márpedig a kémiai szerkezetből pontosan kiszámítható, hogy melyek a membránba ágyazódott szakaszok. Simon professzor csoportja két ilyen módszert dolgozott ki, amelyek beépíthetők a számítógépes programokba. Ezek a kutatási eredmények óriási visszhangot váltottak ki a szakmában: a nemzetközi folyóiratokban megjelent cikkek szokatlanul sok hivatkozást kaptak az elmúlt 10-15 évben. Sőt, a dicsőség pénzzel is kiegészül: a profitorientált cégeknek, például a gyógyszergyáraknak, fizetniük kell, ha a programot használni kívánják.
A másik vizsgált fehérjecsaládról, az úgynevezett rendezetlen fehérjék létezéséről a XX. század végéig nem is tudtunk, a hagyományos fehérjevizsgáló módszerek nem ismerték fel azokat a fehérjéket, amelyek nem csapódtak ki forralásra, vagy nem volt a fehérjékre jellemző fényelnyelésük. Amikor a humángenom vizsgálatok megindultak, kiderült, hogy a fehérjék aminosav sorrendjét – kémiai szerkezetét – nem a fehérjéből érdemes meghatározni, hanem az azt kódoló nukleinsavakból. Így derült fény arra, hogy van egy csomó olyan fajta fehérje, amelyről eddig nem is tudtunk.
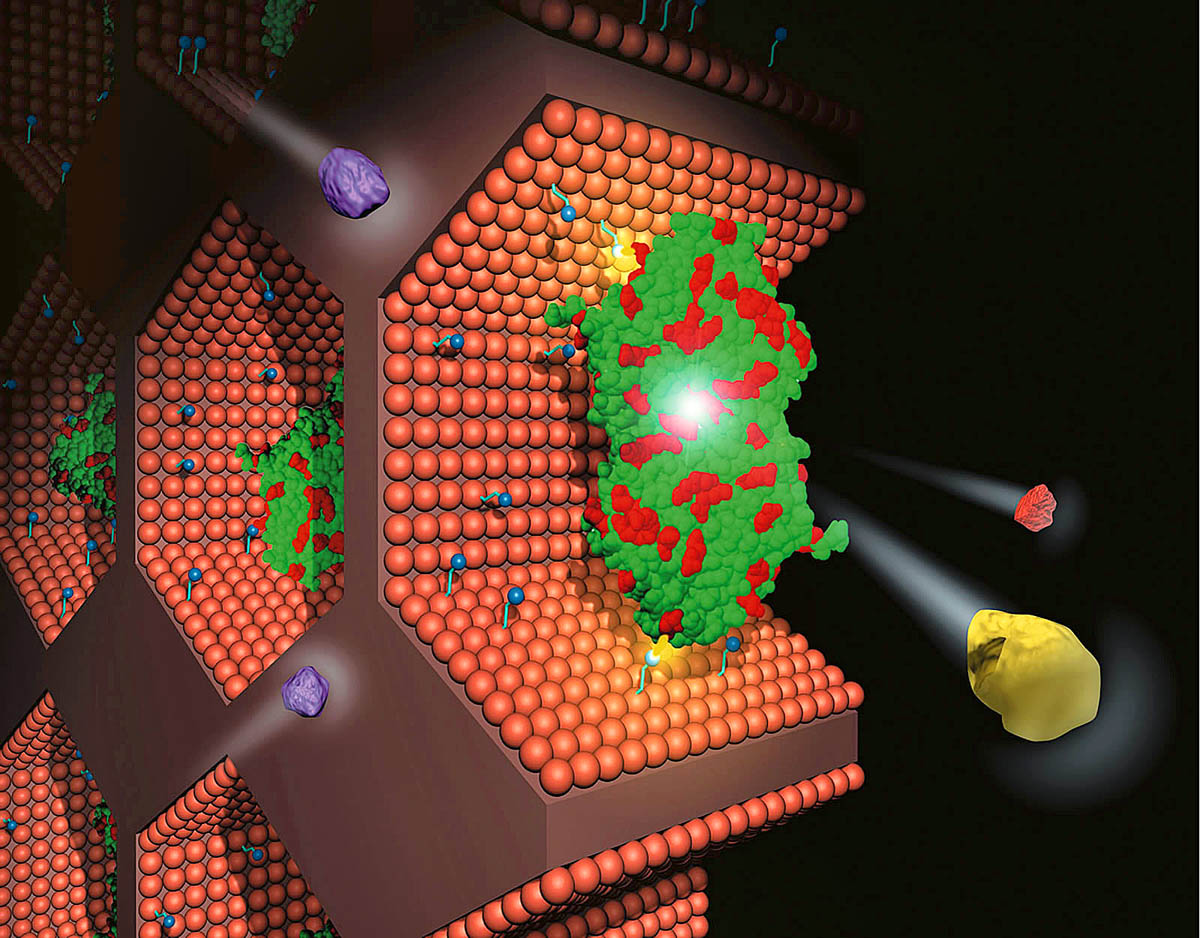
Ezek nem rendelkeznek állandó térszerkezettel, azaz rendezetlenek, kevés van belőlük a szervezetben – ám ezek végzik a jelátviteli és szabályozási funkciók zömét. Életünkben alapvető a jelentőségük. Ezek a rendezetlen fehérjék szabályozzák például a szervezetben a fehérjeszintézist, azt, hogy mikor induljon be, s mennyi szintetizálódjék az egyes fehérjékből. Ezekből a „felügyelőkből” kevesebb van, mint azokból a fehérjékből, amelyeket szabályoznak. Úgy dolgoznak, mint a forgalmi káosz közepén álló rendőr, aki számos járművet irányít egyszerre. A budapesti kutatócsoport dolgozta ki eddig az egyetlen olyan módszert, amellyel azonosíthatók ezek a rendezetlen gének, és amellyel meg lehet határozni, hogy e rendezetlen fehérjéknek mely darabkája tud más fehérjéhez kötődni.
A felfedezés jelentősége az, hogy ezeknek a darabkáknak a gyógyszerrel való blokkolása bonyolult élettani folyamatokat tud majd befolyásolni. A rendezetlen fehérjék vizsgálatának rendkívül fontos szerepe van a rákkutatásban, hiszen a rosszindulatú elváltozás mindig együtt jár a fehérjék megváltozásával, az úgynevezett mutációk keletkezésével, amikor az egyik aminosav más aminosavval cserélődik ki. A rendezetlen fehérjék sokkal toleránsabbak a mutációkkal szemben, nekik nem kell egyértelmű térszerkezetet felépíteniük, ezért a rákkutatás elméleti hátterének feltárásában jelentős szerepük lehet.